Um dos grandes desafios científicos do século 21, a cura do câncer mobiliza em todo o mundo pesquisadores que fazem disso sua missão de vida. Avanços recentes já tornaram tratamentos tradicionais, como quimioterapia e radioterapia, capazes de curar alguns tipos de tumores.
Em outros casos, novos recursos terapêuticos, como a imunoterapia, aumentam a esperança da redução da mortalidade.
Quando se fala de câncer, é preciso entender que o termo cura é precedido pela remissão, quando a doença se torna indetectável a partir de cinco anos após o fim da terapia. Passado esse período, a probabilidade de reaparecimento cai significativamente, o que é um indicativo de que a pessoa está curada
Entretanto, a cura do câncer não é única, pois não existe um único tipo de câncer. O termo descreve um conjunto de centenas de doenças que podem afetar qualquer órgão ou tecido do nosso corpo ao longo de toda a vida.
O que caracteriza os mais diversos tipos de câncer são a reprodução descontrolada de células doentes e a chance de se reproduzirem em locais distantes do ponto inicial – a metástase.
De acordo com os dados da OMS (Organização Mundial da Saúde), 185 países identificaram no ano passado 18,1 milhões de novos casos de câncer e 9,6 milhões de mortes. Estima-se que o número de novos casos salte para 29,5 milhões em 2040.
No Brasil, foram 582,6 mil casos em 2018, com 218,6 mil óbitos no ano anterior, segundo o Ministério da Saúde. As estimativas de novos casos permaneceram estáveis de 2016 a 2018, segundo o Ministério da Saúde: cerca de 600 mil casos por ano.
O médico Walter Moises, hematologista da EPM/Unifesp (Escola Paulista de Medicina da Universidade Federal de São Paulo), afirma que um eventual aumento dos casos de câncer em todo o mundo está relacionado ao aperfeiçoamento do diagnóstico.
“Estamos tendo mais diagnósticos do que no passado, porque os exames melhoraram e então conseguimos fazer diagnósticos mais precoces. Também tem um aumento da população idosa, que é mais propensa a ter câncer. Além disso, existem fatores da sociedade moderna, urbana, que levam a condições para o desenvolvimento de câncer.”
Embora já existam tratamentos modernos disponíveis no País, os pacientes que dependem exclusivamente do SUS (Sistema Único de Saúde) ainda estão longe de ter acesso a essas terapias.
O aprofundamento no conhecimento sobre a biologia das células tumorais levou à criação de medicamentos capazes de ativar o sistema imunológico e combatê-las. Foi o estudo desse tema que rendeu aos pesquisadores James Patrick Allison, dos Estados Unidos, e Tasuku Honjo, do Japão, o Prêmio Nobel de Medicina em 2018.
A chamada imunoterapia, principal avanço no tratamento oncológico, fortalece o sistema de defesa do organismo do paciente. Juntamente com quimioterapia, cirurgia e radioterapia, forma o quarto pilar das terapias atuais no combate à doença.
Felipe Ades, oncologista do Hospital Alemão Oswaldo Cruz, em São Paulo, explica que os primeiros estudos na área começaram em 2010, voltados inicialmente para o melanoma, o câncer de pele.
“Em 2010, as pesquisas identificaram que existem moléculas que ‘ligam e desligam’ os linfócitos, as células de defesa do nosso corpo. A ativação do sistema imunológico liberava essas células para procurar e matar as células cancerígenas”, explica.
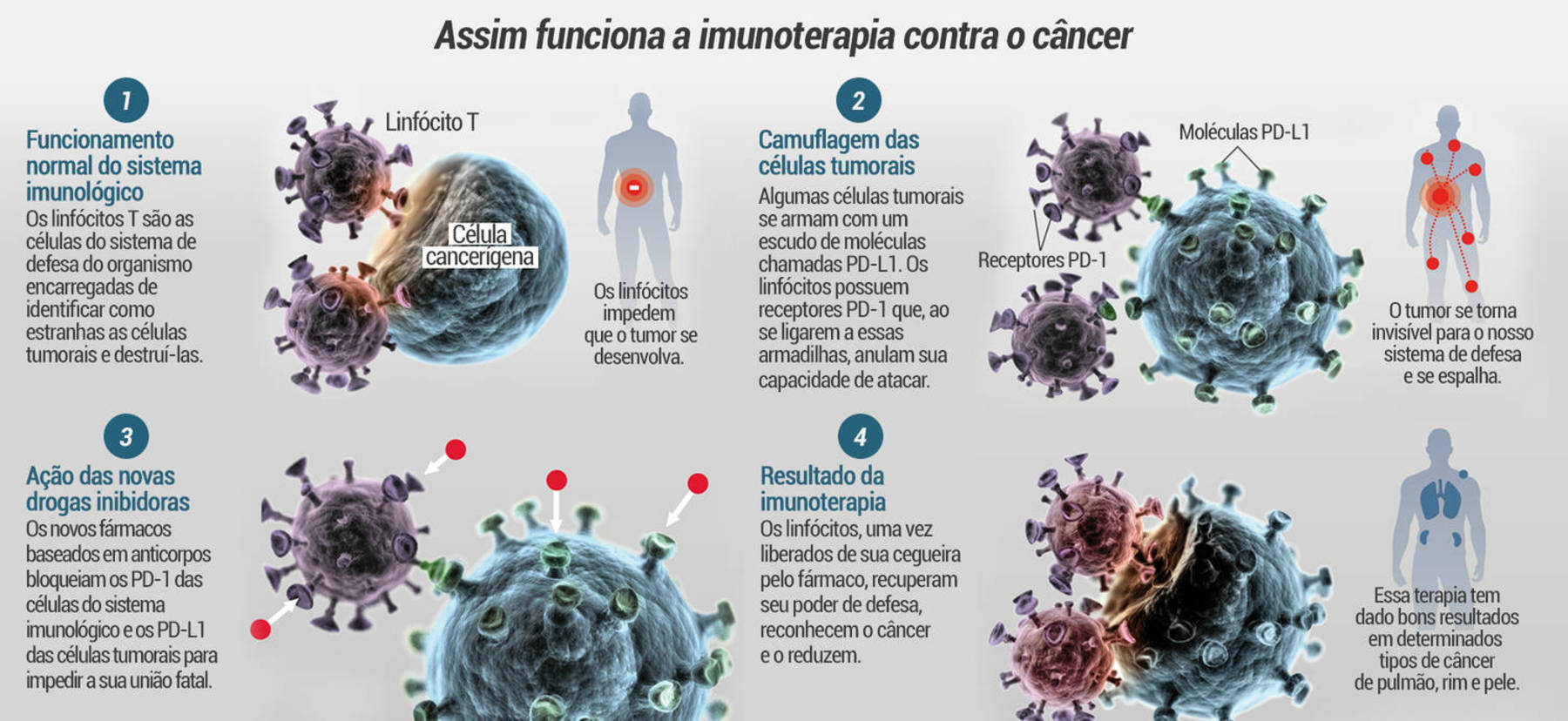
De lá para cá, os resultados foram significativos. “Não havia tratamento capaz de curar metástase em casos de melanoma. Hoje, a imunoterapia cura cerca de 40% dos pacientes”, afirma Ades.
As pesquisas continuam tendo resultados promissores também no tratamento de outros tipos de tumores, como o de pulmão em fumantes, o de mama e o de rins. “A imunoterapia tem sido conciliada com a quimioterapia para esses tipos de câncer”, acrescenta o oncologista.
Ao contrário de algumas quimioterapias agressivas, a imunoterapia não causa perda de cabelo, vômito e outras reações desagradáveis. Mas podem ocorrer problemas autoimunes relacionados à tireoide e inflamações na pele.
Embora promissora, a imunoterapia ainda sofre muitas limitações em termos de difusão no Brasil. A maioria dos brasileiros não terá a oportunidade de tentar a imunoterapia, pelo menos por enquanto. Os fármacos não são oferecidos pelo SUS e uma única infusão tem custo estimado entre R$ 20 mil e R$ 40 mil.
Desde junho de 2018, a Anvisa aprovou dois fármacos utilizados na imunoterapia para o tratamento do câncer de pele: o avelumabe, para carcinoma de Merkel avançado, e o cemiplimabe, para carcinoma espinocelular de pele localmente avançado ou metastático. Ambos podem ser aplicados em pacientes que não sejam candidatos a cirurgia ou radioterapia.
Diagnosticado em 2017 com um linfoma difuso de grandes células B, o tipo mais comum de linfoma não Hodgkin (LNH), o aposentado Vamberto Luiz de Castro, de 64 anos, passou cerca de dois anos recebendo quimioterapia sem sucesso.
A doença evoluiu para um quadro que os médicos já consideravam terminal. Mas um tratamento experimental utilizado pela primeira vez na América Latina teve resultados positivos e pode ter curado o paciente. A confirmação, no entanto, vai depender de exames realizados nos próximos anos.
O tratamento pelo qual Vamberto passou foi a terapia de células CAR-T, sigla em inglês para receptor de antígeno quimérico. Embora já utilizado nos Estados Unidos, a um custo estimado de mais de R$ 1,5 milhão, pesquisadores brasileiros da Universidade de São Paulo (USP) do campus Ribeirão Preto desenvolveram um modelo que pode custar até dez vezes menos: R$ 150 mil.
Integrante da equipe que trabalhou no caso do aposentado, o professor da USP Eduardo Magalhães Rego — coordenador da Hematologia da Oncologia D’Or e diretor da Sociedade Brasileira de Hematologia e Hemoterapia — explica como funciona a terapia a partir de células do próprio paciente.
“O tratamento utiliza o linfócito T, uma célula imune muito ativa. Ele consegue reconhecer a célula cancerígena e matá-la. Por meio de um processo de engenharia genética, criamos uma molécula chamada CAR, que é inserida nas células T. Essas células são desenvolvidas em laboratório e aplicadas de volta no paciente.”
Embora o paciente seja submetido a uma única infusão, existem efeitos colaterais, observa o médico. “Há uma enorme liberação de moléculas que podem ser consideradas inflamatórias”, explica. Por isso, o tratamento precisa ser realizado em um centro que faça transplantes.
O sucesso do tratamento depende da permanência dos linfócitos no paciente, acrescenta o hematologista. “Sabemos que, na primeira análise, 30% dos linfócitos que o paciente Vamberto tem em circulação vieram dos modificados. Em outros casos, já tratados nos Estados Unidos e na Europa, sabemos que esses linfócitos podem durar anos.”
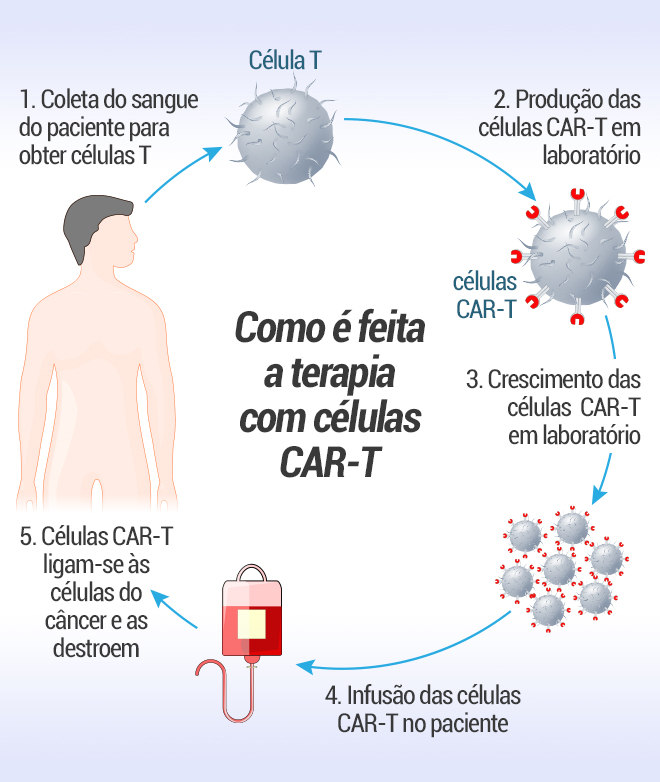
“É um procedimento muito caro. O mais difícil é que esse procedimento de recolher os linfócitos, transformá-los geneticamente e depois amplificar exige laboratórios muito avançados”, acrescenta o pesquisador.
Até o momento, as células CAR-T são usadas apenas contra alguns tipos de câncer de sangue. A quimioterapia continua sendo o tratamento de primeira linha para leucemias e linfomas, mas Rego diz acreditar que a terapia celular tem potencial para ser mais uma opção para pacientes que, como Vamberto, não responderam aos medicamentos.
“Eu tenho certeza de que é uma terapia que veio para ficar. A gente não sabe se vai ser sempre feito da forma como fazemos hoje, pode ser que evolua para uma forma mais fácil.”
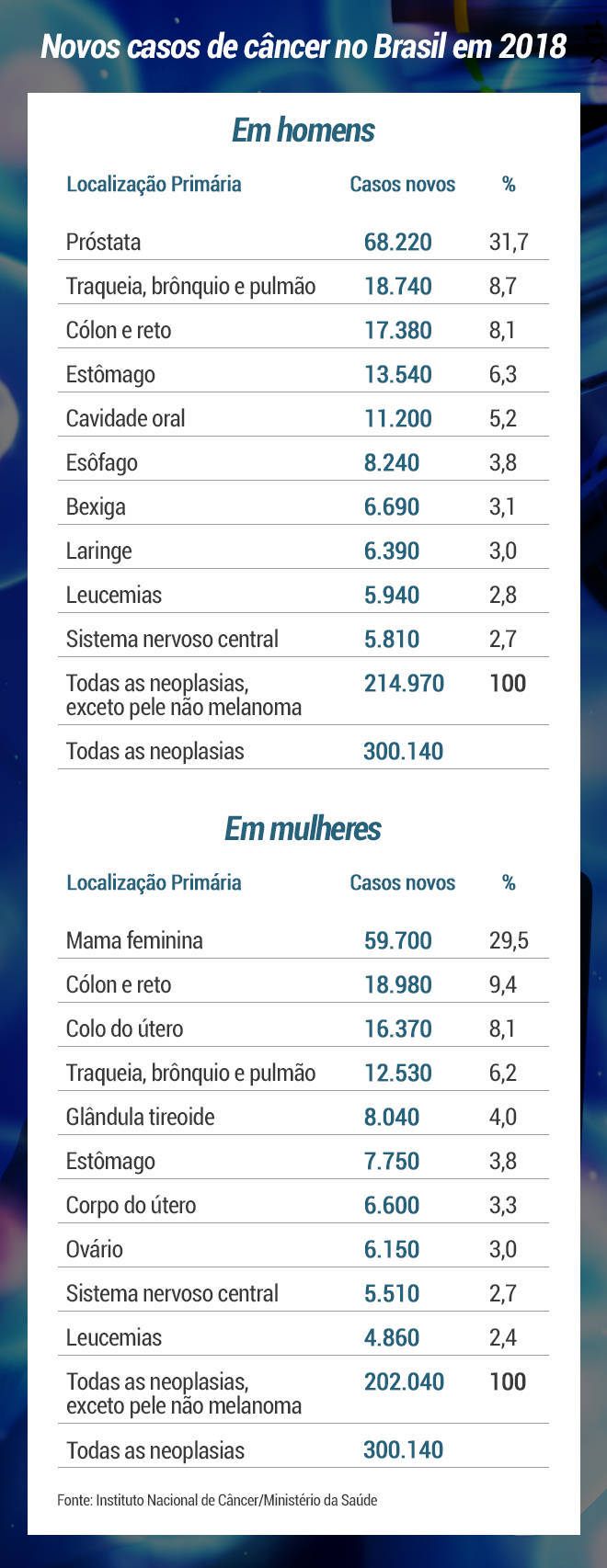
O câncer de próstata é o predominante entre os homens no Brasil. Foram 68,2 mil casos em 2018, sendo o segundo tipo mais mortal da doença em 2017, com 15,4 mil óbitos. Apesar disso, nos últimos 30 anos, após a descoberta do marcador antígeno prostático específico (PSA), diagnosticar esse tipo de tumor antes que se alastre para outras partes do corpo ficou mais fácil.
Na década de 1980, a maioria dos doentes – de 70% a 80% – procuravam o médico já com a doença estabelecida. Com o surgimento do PSA, é possível detectar desde uma infecção até um tumor na próstata.
Confirmado o diagnóstico, a cirurgia de retirada total da glândula pode ser indicada. De uma cirurgia aberta quando padronizada na década de 1980, o procedimento passou para intervenções minimamente invasivas por laparoscopia e, finalmente, com uso da robótica. “A técnica com robô oferece ao médico visão 3D com manipulação das pinças por meio de um joystick”, explica William Nahas, chefe do Serviço de Oncologia Urológica do Instituto do Câncer do Estado de São Paulo (Icesp).
As vantagens da cirurgia robótica em casos de câncer de próstata incluem incisões mais precisas e menores. Consequentemente, menos sangramento e dor. “Em termos de incontinência urinária, nas cirurgias realizadas com robôs, já está documentado que a recuperação do indivíduo é mais rápida”, observa Nahas.
A cirurgia robótica está disponível em alguns hospitais da rede privada, mas são poucos os hospitais que atendem pelo SUS e dispõem desse tipo de aparelho. “Infelizmente é uma tecnologia muito cara. Um robô custa cerca de R$ 6 milhões e tem uma manutenção cara, o que limita seu uso na rede pública”, pondera o professor.
Em maio deste ano, o Icesp, ligado ao Hospital das Clínicas da Faculdade de Medicina da USP (Universidade de São Paulo), realizou a primeira operação do Brasil com utilização de micro-ondas para a remoção de tumores menores que estejam localizados nos rins, fígado, pulmão e ossos.
Chamada de ablação por micro-ondas, a técnica tem como principais vantagens a preservação do órgão afetado e o menor tempo de internação do paciente. O procedimento é feito com uma agulha guiada até o local do tumor por ultrassom ou tomografia e emite micro-ondas que destroem as células tumorais.
Alguns tipos de câncer de próstata também podem ser tratados por outro método de cirurgia não invasiva, o Hifu (High Frequency Ultrassound) Focal One, que utiliza ultrassom de alta frequência.
O tratamento é indicado para pacientes com tipos de tumores específicos, localizados e, geralmente, com baixa agressividade. Segundo o urologista Victor Srougi, do Hospital Moriah, em São Paulo, essa é uma alternativa que evita complicações.
“[O Hifu] pode ser usado em pacientes que não desejam passar pela cirurgia ou radioterapia como tratamento primário. O risco de incontinência urinária e impotência são substancialmente menores do que na cirurgia e na radioterapia, além de ser um procedimento que dura entre uma e duas horas, com alta no mesmo dia.”
É um procedimento simples no qual as ondas agem diretamente no tumor, provocando uma necrose no tecido da próstata afetado pelas células cancerígenas. Áreas sadias não são prejudicadas.
Em São Paulo, o Centro de Referência da Saúde do Homem recebeu o equipamento em 2017. Considerado o mais moderno no tratamento do câncer prostático no país, é o único do SUS e foi adquirido por R$ 3,1 milhões.
As mesmas descobertas em relação às células tumorais que permitiram o desenvolvimento da imunoterapia e da terapia celular (CAR-T) tornaram a quimioterapia mais eficiente, explica o professor da Faculdade de Medicina da USP Paulo Hoff, presidente da Oncologia D’Or e diretor do Hospital Vila Nova Star.
A quimioterapia convencional, afirma o oncologista, é “um envenenamento controlado”, em que as células cancerosas são o foco. Porém, as células boas do organismo também são atingidas e o resultado são pacientes sofrendo alguns efeitos colaterais. O mais marcante deles é a queda de cabelo.
A partir do conhecimento dos tipos de células cancerígenas, cientistas conseguiram criar medicamentos específicos contra cada uma delas.
“Quando conseguimos identificar a molécula dentro da célula cancerosa afetada, podemos desenhar um tratamento molecular específico para essa alteração. Isso vem revolucionando o tratamento do câncer com o que chamamos de terapia molecular ou terapia-alvo”, diz Hoff.
A terapia-alvo oferece resultados positivos, mas ainda tem custos elevados — em torno de R$ 40 mil a R$ 80 mil por mês de tratamento. “A personalização da medicina traz esse desafio de identificar o que funciona para quem precisa. Isso acabou encarecendo o tratamento, embora os resultados em termos de cura e controle da doença sejam cada vez melhores”, ressalta Hoff.
No entanto, ainda é cedo para falar em abandonar a quimioterapia convencional. De acordo com o médico, “ainda hoje ela é a espinha dorsal do tratamento oncológico”. O motivo é que somente agora começaram a surgir medicações não convencionais.
A radioterapia também evoluiu. Com a opção de intensidade modulada (IMRT) é possível aplicar altas doses apenas no tumor e minimizar a radiação nas áreas adjacentes, o que diminui seus efeitos colaterais.
Os principais tipos de tumores tratados com o uso da IMRT atualmente são de próstata, cabeça e pescoço, ginecológicos, gastrointestinais e do sistema nervoso central. Também é uma opção para tratamentos de crianças, por preservar tecidos sadios.
A aplicação de radioterapia como alternativa à cirurgia (técnica chamada de radiocirurgia) também é uma novidade em crescimento. “Em muitas situações, a radioterapia permite que o paciente seja tratado sem a necessidade de uma cirurgia, sem a necessidade de cortes. Já conseguimos fazer tratamentos em pacientes com lesões no pulmão, no fígado, e preservar os tecidos normais”, relata Paulo Hoff.
A Oncologia D’Or é a única no Brasil que possui um equipamento chamado Cyberknife, que utiliza um robô, imagens 3D e feixes de radiação para alvos estacionários e em movimento. Uma das vantagens é que a precisão da máquina permite acompanhar até mesmo a respiração do paciente, para que não haja desvio do feixe em relação ao alvo.
Entre as vantagens, segundo o oncologista, está a redução do tempo de tratamento. “Um tratamento convencional de radioterapia de um câncer de próstata pode levar até oito semanas, enquanto com uma CyberKnife o mesmo tratamento – com a mesma qualidade, mesma segurança, porém mais especificidade, pode ser completado em menos de uma semana”.
O câncer de mama é o mais comum entre as mulheres de todo o mundo. No Brasil, o ano de 2019 foi histórico com a aprovação pela Anvisa da imunoterapia com um medicamento chamado atezolizumabe.
“O câncer de mama foi um dos últimos a se beneficiar da imunoterapia, embora seja uma das doenças mais prevalentes no universo da oncologia”, afirma Daniel Gimenes, oncologista clínico do Centro Paulista de Oncologia do Grupo Oncoclínicas.
A expectativa é de que o tratamento seja indicado para realização na fase inicial da doença, antes da cirurgia de retirada da mama. Trata-se de um anticorpo modificado em laboratório para agir contra a molécula PDL-1, que impede o combate às células cancerosas.
“É uma medicação injetável, oferecida junto com a quimioterapia”, diz Daniel. “Essa associação promove um melhor controle da doença e a possibilidade de nunca mais progredir”, completa.

A terapia deu dez meses a mais de vida para pacientes que participaram da pesquisa IMpassion 130, publicada no New England Journal of Medicine. “Parece pouco, mas é um ganho substancial, porque a gente nunca conseguiu isso no [tratamento] do triplo-negativo”, ressalta.
O triplo-negativo é uma das mais agressivas condutas e corresponde a 15% do total de cânceres de mama. Entretanto, apenas as pacientes que têm a molécula PDL-1 em suas células imunológicas e no tumor podem se submeter à imunoterapia. Elas são 40% das mulheres diagnosticadas.
O oncologista ainda explica que, durante o tratamento, faz-se uma aplicação do atezolizumabe a cada 15 dias e do nab-paclitaxel (um tipo de quimioterapia) uma vez por semana. Ele já trata uma paciente com esse método há um mês e meio, mas os efeitos da terapia ainda não foram avaliados. Porém, ele garante que os efeitos tóxicos da imunoterapia são muito pequenos.
Os medicamentos da imunoterapia são mais tolerados pelo organismo que os quimioterápicos, mas exigem atenção a possíveis inflamações decorrentes do fortalecimento imunológico. Eles, por si só, não causam a queda de cabelo.
“Como a ação é para estimular as células de defesa a atacar o câncer, pode dar inflamações em outros órgãos, como o pulmão. A equipe médica deve estar atenta”, alerta Joyce Lisboa, oncologista clínica do A.C. Camargo e membro do grupo de oncologia mamária e ginecológica.
Ainda de acordo com Daniel, o efeito colateral mais comum é o hipotireoidismo: existe o risco de 5% do sistema imunológico atacar a glândula tireoide. “Mas não deixamos a paciente sentir [os efeitos], porque dosamos o nível do hormônio da tireoide no sangue para fazer o controle”, afirma.
Os tumores luminais, com receptores dos hormônios estrógeno e progesterona, representam mais de 70% dos cânceres de mama. O tratamento mais inovador para esse tipo de câncer usa os chamados “inibidores de ciclina”- uma proteína que regula o ciclo celular.
Trata-se de um tipo de terapia-alvo que impede a divisão e multiplicação das células cancerosas. Três medicamentos desta classe foram aprovados pela Anvisa em 2018, um deles é o ribociclibe.
Todos têm um mecanismo de ação e eficácia semelhante. “É uma classe que veio para inovar o tratamento do câncer de mama metastático e proporcionar à paciente uma melhor qualidade de vida, pois são drogas orais com menos efeitos colaterais que a quimioterapia”, explica Joyce Lisboa, oncologista clínica do A.C. Camargo.
O tratamento para o câncer HER2, que responde a 20% de todas as neoplasias de mama, é o único que pode ser usado tanto para metástase quanto para a fase inicial da doença.
Neste caso é indicado para pacientes que passaram por mastectomia – retirada completa da mama – mas ainda têm células cancerígenas no organismo. O medicamento usado é o T-DM1, uma mistura do anticorpo monoclonal transtuzumabe com a quimioterapia entansina.
O medicamento liga-se à proteína HER2 das células e ajuda a quimioterapia a adentrá-las para fazer o bloqueio, explica a especialista. A aplicação do T-DM1 é feita via infusão e ocorre a cada 21 dias. O tratamento pode gerar náuseas, fadiga, dores musculares e prisão de ventre. No geral, não há queda de cabelo.
O objetivo agora é estender a imunoterapia para o tratamento de tumores luminais e HER2, de acordo com Gimenes. “É o grande arsenal que a gente vai ouvir falar cada vez mais nos próximos anos e a perspectiva é ampliar para outros tipos de câncer. Por isso, estamos aguardando com muita euforia os resultados da terapia na prática”.
R7















